Rynek badań klinicznych w Polsce
2007-01-11 00:33
Przeczytaj także: Rynek badań klinicznych 2012
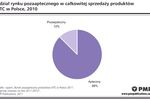
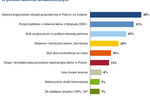
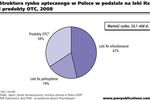
Klimat dla badań klinicznych znacznie pogorszył się po 2004 r., na skutek niekorzystnej dla firm przeprowadzających badania interpretacji zapisu dyrektywy europejskiej 2001/20/WE o dopuszczalnym czasie rejestracji badania klinicznego w Polsce. Dyrektywa określa 60 dni jako maksymalny czas, w którym odpowiedni urząd, w przypadku Polski CEBK, ma na rozpatrzenie wniosku o wydanie zezwolenia na prowadzenie badania. W praktyce okazało się, że polski urząd potraktował okres, o jakim wspomina Dyrektywa, nie jako czas maksymalny, ale obowiązujący, w wyniku czego znacznie wydłużył się czas rejestracji projektu w Polsce.Pod koniec 2006 r. niektórzy przedstawiciele firm zaczęli wyrażać nadzieję na poprawę sytuacji na rynku. Firmy, które jeszcze w latach 2004-2005 rezygnowały z przeprowadzania niektórych badań klinicznych na terenie Polski z powodu bardzo długiego w porównaniu do innych krajów czasu rejestracji, w 2006 r. zwiększyły ponownie swoje wydatki na badania kliniczne w kraju. Przyczyną tej decyzji była znacząca poprawa jakości współpracy z CEBK, szczególnie w zakresie likwidacji biurokratycznych barier w rejestracji badania. Według autorów raportu, większość firm zajmujących się badaniami klinicznymi w Polsce uważa, że zmiany wprowadzone pod koniec roku w procedurze rejestracji idą zasadniczo w dobrym kierunku i mogą przyczynić się do ponownego zainteresowania Polską jako miejscem przeprowadzania badań klinicznych.
fot. mat. prasowe
 Rynek badań klinicznych 2008
Rynek badań klinicznych 2008
1 2
oprac. : Aleksander Walczak / eGospodarka.pl

Przeczytaj także
Najnowsze w dziale Wiadomości
-
![Suwerenność AI priorytetem dla 79 proc. firm. Co to oznacza w praktyce? [© pexels] Suwerenność AI priorytetem dla 79 proc. firm. Co to oznacza w praktyce?]()
Suwerenność AI priorytetem dla 79 proc. firm. Co to oznacza w praktyce?
-
![Rynek reklamy w Polsce - kto zyskuje, kto traci? Najnowsze dane [© pexels] Rynek reklamy w Polsce - kto zyskuje, kto traci? Najnowsze dane]()
Rynek reklamy w Polsce - kto zyskuje, kto traci? Najnowsze dane
-
![Rynek pracy 2026: dlaczego szybkość uczenia się i elastyczność zdecydują o sukcesie zawodowym? [© wygenerowane przez AI] Rynek pracy 2026: dlaczego szybkość uczenia się i elastyczność zdecydują o sukcesie zawodowym?]()
Rynek pracy 2026: dlaczego szybkość uczenia się i elastyczność zdecydują o sukcesie zawodowym?
-
![Rynek pracy w Polsce: Bezrobocie rośnie, ale AI tworzy nowe miejsca pracy [© wygenerowane przez AI] Rynek pracy w Polsce: Bezrobocie rośnie, ale AI tworzy nowe miejsca pracy]()
Rynek pracy w Polsce: Bezrobocie rośnie, ale AI tworzy nowe miejsca pracy






![Chcemy leków z Europy [© Scanrail - Fotolia.com] Chcemy leków z Europy](https://s3.egospodarka.pl/grafika/leki/Chcemy-lekow-z-Europy-apURW9.jpg)
![Czy leki stanieją? Rynek farmaceutyczny już płaci cenę [© freepik] Czy leki stanieją? Rynek farmaceutyczny już płaci cenę](https://s3.egospodarka.pl/grafika2/branza-farmaceutyczna/Czy-leki-stanieja-Rynek-farmaceutyczny-juz-placi-cene-268157-150x100crop.jpg)



![Rejestracja leków: konieczna integracja [© Syda Productions - Fotolia.com] Rejestracja leków: konieczna integracja](https://s3.egospodarka.pl/grafika/rejestracja-lekow/Rejestracja-lekow-konieczna-integracja-d8i3B3.jpg)

![Sprzedaż samochodów 2006 [© Scanrail - Fotolia.com] Sprzedaż samochodów 2006](https://s3.egospodarka.pl/grafika/sprzedaz-samochodow/Sprzedaz-samochodow-2006-apURW9.jpg)
![Suwerenność AI priorytetem dla 79 proc. firm. Co to oznacza w praktyce? [© pexels] Suwerenność AI priorytetem dla 79 proc. firm. Co to oznacza w praktyce?](https://s3.egospodarka.pl/grafika2/AI/Suwerennosc-AI-priorytetem-dla-79-proc-firm-Co-to-oznacza-w-praktyce-270906-150x100crop.jpg)
![Rynek reklamy w Polsce - kto zyskuje, kto traci? Najnowsze dane [© pexels] Rynek reklamy w Polsce - kto zyskuje, kto traci? Najnowsze dane](https://s3.egospodarka.pl/grafika2/reklama/Rynek-reklamy-w-Polsce-kto-zyskuje-kto-traci-Najnowsze-dane-270903-150x100crop.jpg)
![Rynek pracy 2026: dlaczego szybkość uczenia się i elastyczność zdecydują o sukcesie zawodowym? [© wygenerowane przez AI] Rynek pracy 2026: dlaczego szybkość uczenia się i elastyczność zdecydują o sukcesie zawodowym?](https://s3.egospodarka.pl/grafika2/rynek-pracy/Rynek-pracy-2026-dlaczego-szybkosc-uczenia-sie-i-elastycznosc-zdecyduja-o-sukcesie-zawodowym-270904-150x100crop.jpg)
![Rynek pracy w Polsce: Bezrobocie rośnie, ale AI tworzy nowe miejsca pracy [© wygenerowane przez AI] Rynek pracy w Polsce: Bezrobocie rośnie, ale AI tworzy nowe miejsca pracy](https://s3.egospodarka.pl/grafika2/stopa-bezrobocia/Rynek-pracy-w-Polsce-Bezrobocie-rosnie-ale-AI-tworzy-nowe-miejsca-pracy-270892-150x100crop.jpg)
![Ranking lokat i kont oszczędnościowych. Przegląd możliwości dostępnych w sierpniu 2025 [© Freepik] Ranking lokat i kont oszczędnościowych. Przegląd możliwości dostępnych w sierpniu 2025](https://s3.egospodarka.pl/grafika2/najlepsze-lokaty/Ranking-lokat-i-kont-oszczednosciowych-Przeglad-mozliwosci-dostepnych-w-sierpniu-2025-268073-150x100crop.jpg)
![Skuteczny artykuł sponsorowany - jak napisać i gdzie publikować? [© Tierney - Fotolia.com] Skuteczny artykuł sponsorowany - jak napisać i gdzie publikować?](https://s3.egospodarka.pl/grafika2/artykul-sponsorowany/Skuteczny-artykul-sponsorowany-jak-napisac-i-gdzie-publikowac-216067-150x100crop.jpg)
![Jak korzystnie przelewać pieniądze do Polski pracując za granicą? [© v.poth - Fotolia.com] Jak korzystnie przelewać pieniądze do Polski pracując za granicą?](https://s3.egospodarka.pl/grafika2/przelewy/Jak-korzystnie-przelewac-pieniadze-do-Polski-pracujac-za-granica-230796-150x100crop.jpg)
![Delegacje krajowe i zagraniczne: nowe stawki diety przy podróżach służbowych od 29.11.2022 i 01.01.2023 [© Nejron Photo - Fotolia.com] Delegacje krajowe i zagraniczne: nowe stawki diety przy podróżach służbowych od 29.11.2022 i 01.01.2023](https://s3.egospodarka.pl/grafika2/koszty-podatkowe/Delegacje-krajowe-i-zagraniczne-nowe-stawki-diety-przy-podrozach-sluzbowych-od-29-11-2022-i-01-01-2023-249192-150x100crop.jpg)
![Co zmienia darmowy dostęp do Rejestru Cen Nieruchomości? [© pexels] Co zmienia darmowy dostęp do Rejestru Cen Nieruchomości? [© pexels]](https://s3.egospodarka.pl/grafika2/Rejestr-Cen-Nieruchomosci/Co-zmienia-darmowy-dostep-do-Rejestru-Cen-Nieruchomosci-270800-50x33crop.jpg) Co zmienia darmowy dostęp do Rejestru Cen Nieruchomości?
Co zmienia darmowy dostęp do Rejestru Cen Nieruchomości?




![Co może windykator a co komornik? Różnice i uprawnienia [© pexels] Co może windykator a co komornik? Różnice i uprawnienia](https://s3.egospodarka.pl/grafika2/komornik/Co-moze-windykator-a-co-komornik-Roznice-i-uprawnienia-270905-150x100crop.jpg)
![Kiedy zakup nieruchomości w Hiszpanii może uczynić Cię rezydentem podatkowym i jakie podatki zapłacisz? [© wygenerowane przez AI] Kiedy zakup nieruchomości w Hiszpanii może uczynić Cię rezydentem podatkowym i jakie podatki zapłacisz?](https://s3.egospodarka.pl/grafika2/rezydencja-podatkowa/Kiedy-zakup-nieruchomosci-w-Hiszpanii-moze-uczynic-Cie-rezydentem-podatkowym-i-jakie-podatki-zaplacisz-270891-150x100crop.jpg)
![Podział udziałów w spółce. Dlaczego model 50/50 może być pułapką i jak jej uniknąć? [© wygenerowane przez AI] Podział udziałów w spółce. Dlaczego model 50/50 może być pułapką i jak jej uniknąć?](https://s3.egospodarka.pl/grafika2/wspolnicy-spolki/Podzial-udzialow-w-spolce-Dlaczego-model-50-50-moze-byc-pulapka-i-jak-jej-uniknac-270887-150x100crop.jpg)
![Faktura w walucie obcej w KSeF. Co się zmieniło i jak unikać błędów? Nowe zasady i obowiązki [© wygenerowane przez AI] Faktura w walucie obcej w KSeF. Co się zmieniło i jak unikać błędów? Nowe zasady i obowiązki](https://s3.egospodarka.pl/grafika2/faktury-w-walutach-obcych/Faktura-w-walucie-obcej-w-KSeF-Co-sie-zmienilo-i-jak-unikac-bledow-Nowe-zasady-i-obowiazki-270879-150x100crop.jpg)
![Bezpłatne szkolenia z AI od Google i SGH. Rusza nowa edycja "Umiejętności Jutra AI". Jak wziąć udział? [© wygenerowane przez AI] Bezpłatne szkolenia z AI od Google i SGH. Rusza nowa edycja "Umiejętności Jutra AI". Jak wziąć udział?](https://s3.egospodarka.pl/grafika2/AI/Bezplatne-szkolenia-z-AI-od-Google-i-SGH-Rusza-nowa-edycja-Umiejetnosci-Jutra-AI-Jak-wziac-udzial-270878-150x100crop.jpg)

![Wzrost PKB nie pomógł. Rekordowa liczba niewypłacalności firm w 2025 roku [© pexels] Wzrost PKB nie pomógł. Rekordowa liczba niewypłacalności firm w 2025 roku](https://s3.egospodarka.pl/grafika2/niewyplacalnosc-firmy/Wzrost-PKB-nie-pomogl-Rekordowa-liczba-niewyplacalnosci-firm-w-2025-roku-270876-150x100crop.jpg)